「生命現象を有機化学反応式で記述する」というVisionのもと、酵素タンパク質の研究をしています。
酵素タンパク質は触媒として働き、遷移状態の分子を選択的に安定化させることで化学変換反応速度を著しく上昇させる素晴らしい分子マシーンです。この触媒能力について、我々は特に「高い不斉識別能力」と「制御された反応空間場」の二つに着目し、生化学的な視点だけでなく、有機化学的な視点からも見つめた研究を展開しています。これらにフォーカスした基礎研究を行うことで、酵素タンパク質の基質認識や触媒能力発現機構の解明を目指すと共に、活性部位の特異な空間を利用した新しい反応制御技術の確立を試みています。酵素タンパク質の有する可能性を見出し、その能力を最大限に高めながら、最終的に有用物質の生産に結びつけることが目標です。
そしてこれらの研究活動を通して「地球環境再生に向けた持続可能な資源循環」つまり、大量生産大量消費だけではない新しい産業創出のための基盤を創り、使用前から使用後の行方まで考えた自然と共生・一体化する消費活動を目指したSDGsに貢献したいと考えています!

 →
→ 



ホタル生物発光に関わる酵素の研究
ターゲットはホタル由来の酵素タンパク質
ホタルの発光は、酵素ホタルルシフェラーゼが、基質D-ルシフェリンをオキシルシフェリンへと化学変換することで実現されます。本現象は化学発光の一種であり、蛍光発光と比較して信号(signal)とノイズ(noise)の比(S/N比)が高いこと、細胞深部の標的でも検出可能であること等の優位性から、医療・食品など様々な分野における検出やバイオイメージング手法として応用されています。特にin vivoイメージングの重要性は年々高まっており、これまで多くの疾病メカニズムの解明や投与薬物の物質動態可視化に貢献してきました。このようにライフサイエンス分野の研究に必要不可欠な手法であるホタル発光反応ですが、実はまだまだ分からないことが多数残されており、学術的な視点から見ると研究し甲斐のあるチャレンジングな研究対象です!
例えばホタルの発光色ひとつとってもそうです。天然型のホタルルシフェラーゼは黄緑色に発光しますが、タンパク質工学的手法にてアミノ酸置換を施すとオレンジや赤色にもなります。しかし、この発光色制御機構は完全には解明されていません。そこで我々は、発光色を決定するメカニズムを明らかにし発光色を自在に制御するための研究を進めています。
また本酵素は、発光反応だけでなく一見全く違った反応に見えるカルボン酸の立体選択的チオエステル化も触媒(アシル-CoA合成活性)できる二機能性酵素です。この珍しい性質に魅了され研究を進めたところ、二機能性が酵素活性の進化や、基質D-ルシフェリンの生合成と密接に関連していることが分かってきました。

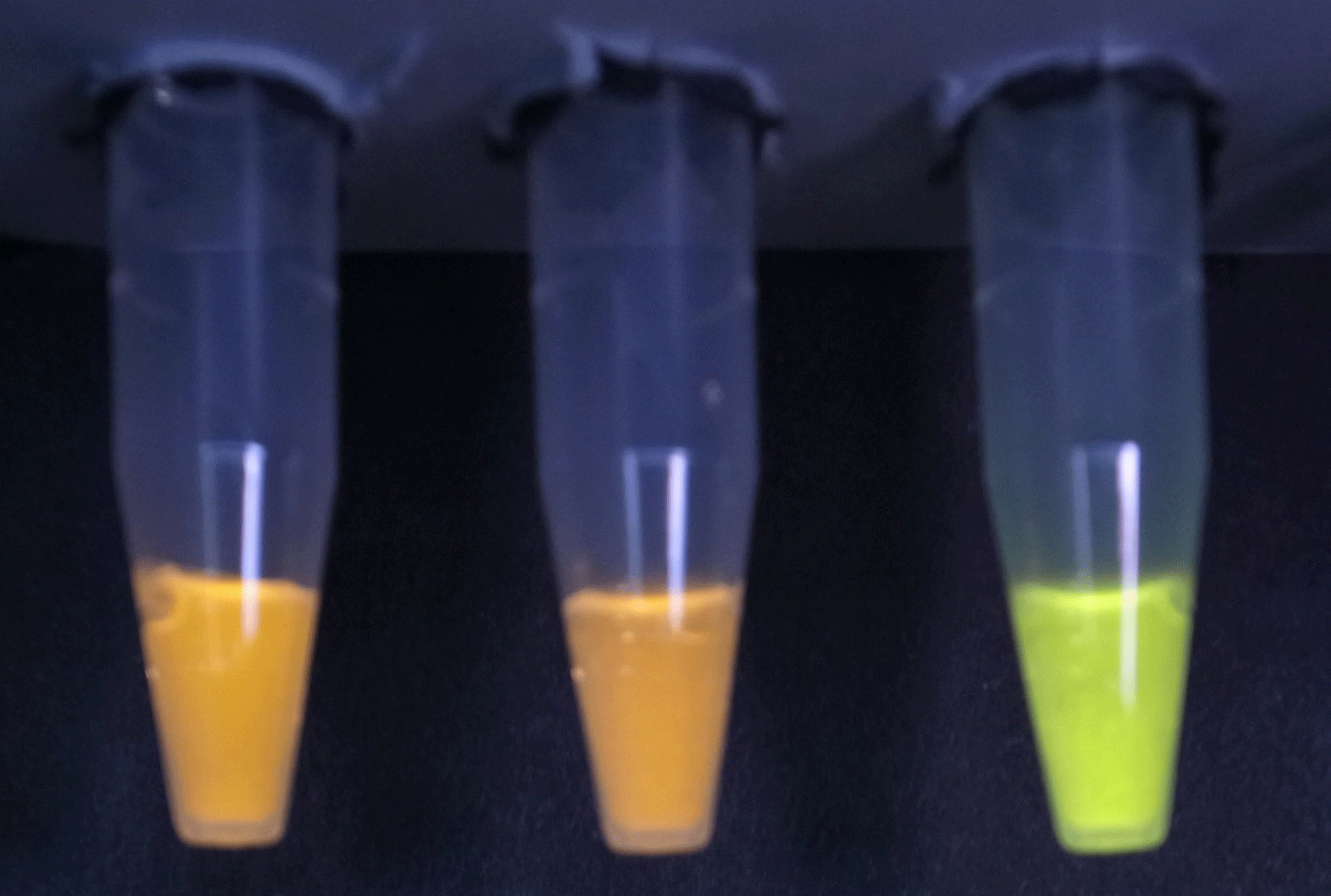
キラルフリーホタル発光システムの開発
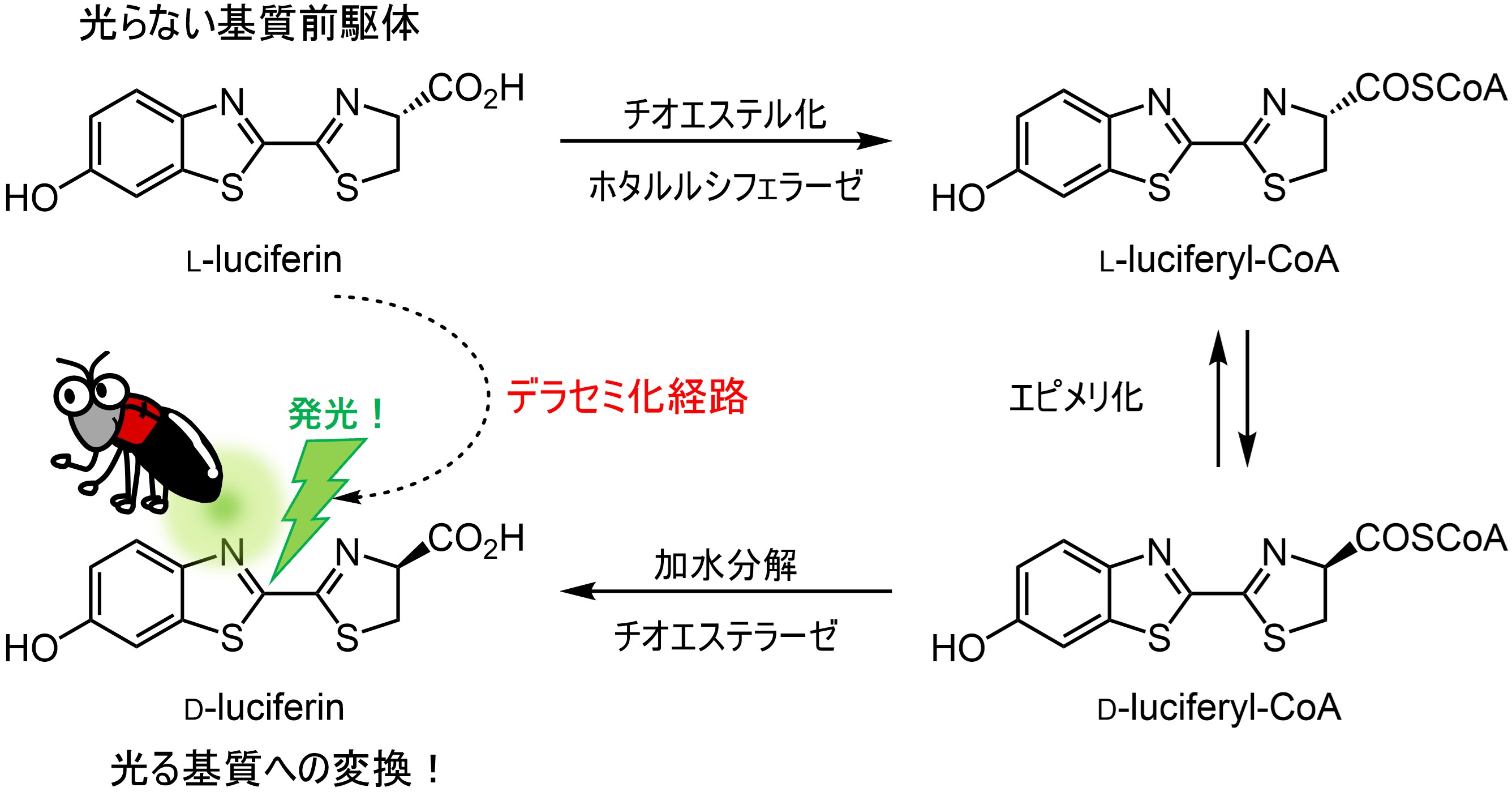
我々は発光基質D-ルシフェリンの調製方法として、発光しないはずのL-ルシフェリンを利用する新奇な発光システムを構築しました。L-ルシフェリンは発光基質D-ルシフェリンの鏡像異性体で本来ならば強力な発光阻害剤として働きますが、ホタルルシフェラーゼのもう一つの触媒活性である立体特異的なアシル-CoA合成活性とチオエステラーゼという2種類の酵素を組み合わせて作用させることで立体が反転し、発光する基質へと変換されます(デラセミ化経路)。特に生体内では、環境によってD-ルシフェリンは容易にラセミ化するため、in vivoイメージングの定量性・再現性に悪影響を与えてしまっていました。本システムを利用することで、基質の不斉によらないキラルフリー発光が実現できるだけでなく、安定した発光量を確保することが可能となると期待しています。また本経路がホタル体内でも機能し、発光基質D-ルシフェリンはL-ルシフェリンから合成されることを確認しました!
ホタルルシフェリン生合成経路の解明
我々の研究によって、発光基質D-ルシフェリンの前駆体は、その鏡像異性体のL-ルシフェリンであることはわかりましたが、それ以外の生合成経路については不明のままです。分かっているのは1分子の1,4-ベンゾキノンと2分子のシステインから合成されているだろうということだけです。つまり1,4-ベンゾキノンからL-ルシフェリンまでの間には大きなミッシングリンクが存在するのです。我々はどのような酵素タンパク質がD-ルシフェリン生合成に関わっているのかを明らかにする研究も進めています。
ゲンジボタルのゲノムレベルでの遺伝子解析
ホタルは、甲虫目ホタル科に分類される昆虫で、世界でおよそ2,800種、日本だけでも54種が生息しており古くは日本書紀にもホタル生物発光に関する記述がみられます。その中でもゲンジボタル (学名Luciola cruciata)は日本固有種として、昔から日本人に最も親しまれてきた光る生き物の代表格です。しかしゲンジボタルと一口に言っても、日本各地に生息する本種の発光周期にはいわゆる地理的方言があることが知られています。特に大きな違いは、新潟-長野-静岡にまたがる中部山岳地域 (フォッサマグナ地帯) を境として、発光間隔が短周期型 (2秒西日本型) と長周期型 (4秒東日本型) の2つに大別される点です。我々は、ゲンジボタルの全ゲノムアノテーション解析情報を基にしたゲノムレベルでの網羅的なDNA変異解析によって生息場所と発光周期の関連付けを試み、大きく3つの地理的集団 (東本州型、西本州型、九州型) に分けられることを明らかにしました。
↓我々のプレス発表の一部です。
2020.01.31 「ゲンジボタルは日本全国同じじゃない!」
2020.12.02 「1億年前のホタルの光を再現 -現代に甦らせた原初のホタルの光は深い緑色だった-」
ナイロン分解に関わる酵素の研究
ターゲットはポリアミド「ナイロン」を加水分解できる酵素タンパク質
皆さんは高分子ナイロンを加水分解できる酵素タンパク質の存在を知っていますか?
合成ポリアミドであるナイロンは、6-ナイロンや6,6-ナイロンが有名です。これらは強靱性と柔軟性だけでなく耐熱性や耐薬品性も併せ持つことから、繊維・プラスチック素材として我々の生活のいたる所で利用されています。しかし、生物分解を受けにくいため、利用後はほとんどが焼却あるいは埋め立て処分されているという現実があります。同じプラスチックであるポリエチレンテレフタレート(PET;こちらは合成ポリエステルです)が、日本国内において高いリサイクル率を示すこととは対照的な状況です。合成ナイロンが化石燃料から合成されることを考えても、環境に負荷をかけないリサイクル方法の提案が望まれます。しかし、高分子ナイロンをリサイクルしやすいよう、モノマーへときれいに加水分解することは、その特性上簡単ではありません。
我々の研究グループではナイロン合成の過程で生じる6-アミノカプロン酸(Ahx)オリゴマーを分解する微生物を単離すると共に、その分解に関わる酵素タンパク質の遺伝的・生化学的研究を行ってきました。また2012年には不溶物である高分子ナイロンに対して高い加水分解活性を示す非常に珍しい酵素、ナイロン加水分解酵素(nylon hydrolase)の創出にも成功しています。
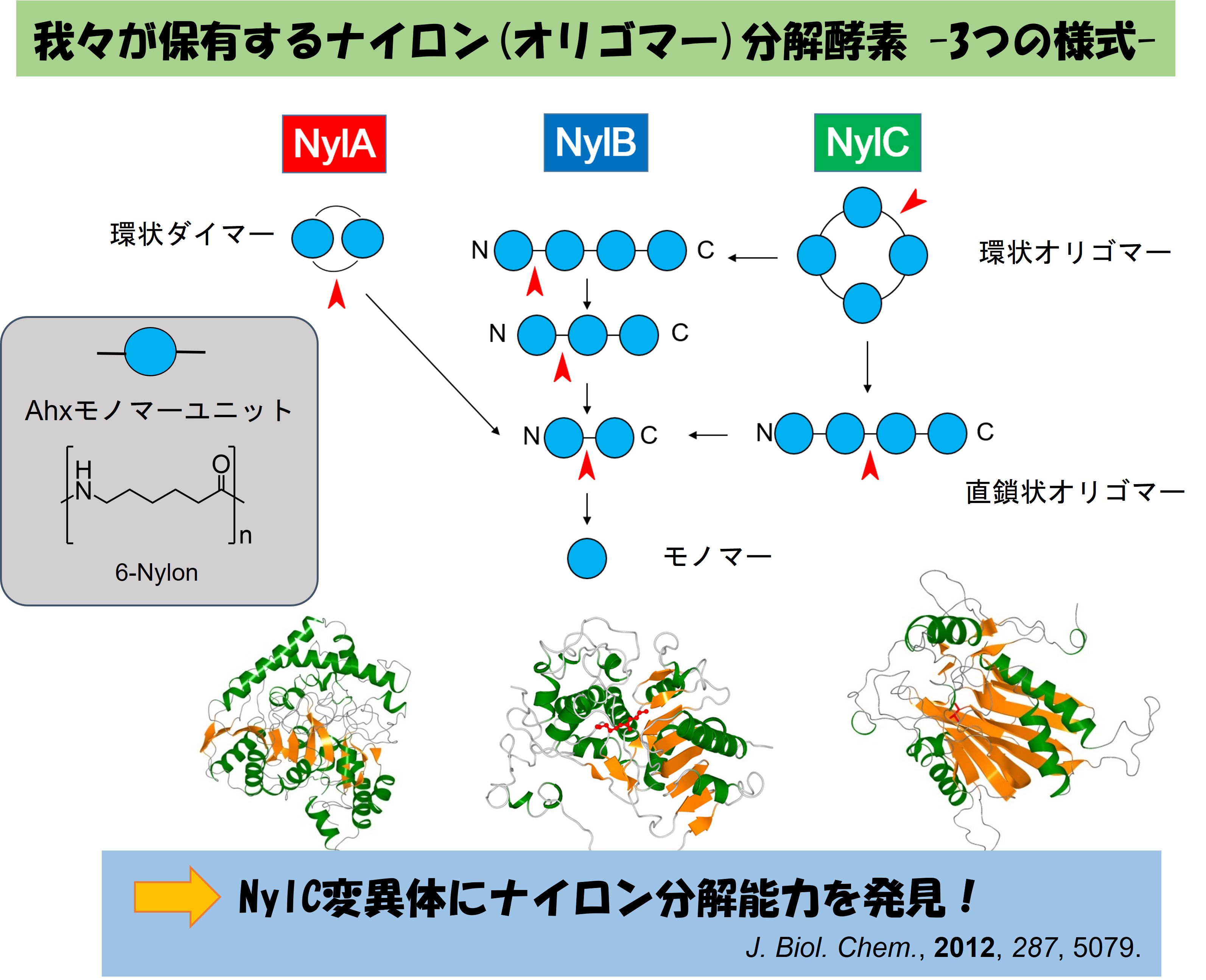
2020年度からは国立研究開発法人新エネルギー・産業技術総合開発機構(NEDO)の「ムーンショット型研究開発事業」におけるムーンショット目標4「2050年までに、地球環境再生に向けた持続可能な資源循環を実現」の達成を目指す研究開発プロジェクトの一つに採択され、ナイロン加水分解酵素(nylon hydrolase)に関わる研究を加速させています!
 ←JAIST金子達雄教授PMの「光スイッチ型海洋分解性の可食プラスチックの開発研究」に参画しています!
←JAIST金子達雄教授PMの「光スイッチ型海洋分解性の可食プラスチックの開発研究」に参画しています!
ファージディスプレイ技術を利用した抗体の研究
これまで世の中になかった新しい機能を持つタンパク質の創出
M13バクテリオファージを用いたファージディスプレイ技術とアルパカやドチザメ由来の特殊なシングルドメイン抗体を組み合わせることによって認識能力の異なる抗体タンパク質のライブラリを作製し、ここから新しい機能を有するタンパク質の創出にチャレンジしています。酵素タンパク質は遷移状態の分子と結合する一方、抗体は基底状態の分子と選択的に結合します。二つのタンパク質が取っている認識方法・戦略は同じなのでしょうか、それとも違いがあるのでしょうか?我々はこの違いについても興味を持って研究を行っています。
↑




 ←JAIST金子達雄教授PMの「光スイッチ型海洋分解性の可食プラスチックの開発研究」に参画しています!
←JAIST金子達雄教授PMの「光スイッチ型海洋分解性の可食プラスチックの開発研究」に参画しています!